Modification des protéines
1- Modification chimique du gluten
Méthode :
* L'acylation est une technique qui permet de mieux solubiliser le gluten dans des zones de pH comprises entre 7 et 9. On constate que pour ces glutens traités il y a une diminution du volume du pain et une perte de l'extensibilité. Cette constatation est très faible dans le cas de l'utilisation de l'anhydride maléique ou succinique. La phosphorylation augmente les capacités de rétention en eau du gluten.
* Le traitement du gluten par l'acide chlorhydrique entraîne la désamidation de l'asparagine et de la glutamine en restaurant le caractère acide de ces molécules. Il y a de ce fait une augmentation de la solubilité du gluten, un pouvoir accru de stabilisation des émulsions analogue à celui de la sérumalbumine bovine ou à la béta-lactoglobuline. On note un accroissement des propriétés moussantes.
* Les réactions de blocage des fonctions ε-NH2 de la lysine entraîne une diminution de la rétention en eau et une diminution du volume du pain.
* La réduction du gluten par le sulfite ou le bisulfite de potassium ou de sodium se traduit par une texturation des protéines qui est utilisée après addition d'autres ingrédients (agent moussant, amidon, caséine...) comme succédané de la chair de crabe.
* le traitement du gluten ou d'hydrolysat de gluten par de l'oxyde d'éthylène conduit à un mélange soluble dans l'eau ou dans divers solvants organiques. Le gluten époxydé confère aux résines acryliques des propriétés adhésives et plastiques : il permet la fabrication de film qui peuvent être utilisés comme emballage spécial. Le problème des emballages est quelque chose d'intéressant surtout si on se place d'un point de vue technologique et écologique. En industrie agroalimentaire on sait fabriquer des emballages à partir de polysaccharide ou de lipides. On maîtrise parfaitement les premiers qui résistent bien aux huiles et matières grasses mais sont peu résistant à l'eau. Les deuxièmes constituent une excellente barrière vis-à-vis de l'humidité et peuvent être le support de molécules liposolubles. Ils présentent cependant trois facteurs limitants : ils ne constituent pas un film indépendant du produit car trop fragile, leur aspect graisseux et leur goût cireux est peu attractif enfin ils peuvent rancir en fonction du temps et de la teneur en oxygène. Un emballage alimentaire doit présenter les propriétés suivantes : film alimentaire indépendant, incolore, inodore et sans saveur. Il doit être imperméable aux gaz et doit limiter les mouvements d'eau (cas des pizzas et des pâtisseries fourrées, produits frais ou congelés), d'huile (viandes, poissons panés destinées à être frits) et la migration de solutés indésirables vers l'aliment et d'arômes vers le milieu extérieur.
Les films protéiques sont peu utilisés en industrie agroalimentaire car ils sont peu résistant à l'eau (gélatine en pharmacie, film de zéïne en industrie agroalimentaire). Il apparaît maintenant que les films de gluten pourraient être utilisés dans le secteur alimentaire car il est hydrophobe et on peut l'obtenir aisément sous forme des films. Le gluten est dispersé à 12,5% dans de l'éthanol puis étalé sous forme de film mince afin d'obtenir l'évaporation du solvant. La solution présente de bonnes caractéristiques filmogènes à la condition que le milieu soit acide (pH5) l'introduction d'acide acétique permet d'atteindre cette valeur. L'addition d'un agent plastifiant comme le glycérol est indispensable pour améliorer les propriétés mécaniques du film (épaisseur 0,05mm). Le film de gluten est susceptible de reprendre de l'eau en fonction des conditions du milieu et le gluten pourra subir une transition vitreuse qui est dépendante de la température. La zone de transition est, pour une teneur en eau de 5% à 50°C ou de 5°C pour une teneur en eau de 30%. En deçà de cette limite, le film est à l'état vitreux, il est élastique, résistant et relativement imperméable à l'eau. Au delà de cette zone, il perd ses propriétés.
Ces films semblent devoir se développer dans l'avenir car le gluten est susceptible d'être traité en extrudeur pour y être traité par injection-moulage. La limite à l'utilisation est encore une susceptibilité trop grande à l'eau. Il serait intéressant d'introduire dans la maille de gluten des molécules lipophiles de façon à augmenter le caractère hydrophobe des films.
2- Modification enzymatique du gluten
Les protéases qui sont utilisées sont de deux types : les protéases acides (pH optimum voisin de pH 4) et les protéases basiques (pH optimum compris entre 7 et 9). Ce sont des protéases à sérine dont la réactivité est voisine de celle de la subtilisine. Ces protéases existent dans les graines en dormance, elles s'expriment au cours de la germination et au cours de la panification (protéase acide pendant la fermentation, les protéases basiques au niveau du pétrissage). Si on veut obtenir des modifications plus importantes il est nécessaire d'utiliser des protéases exogènes (micro-organismes, végétales ou fongiques) et on travaillera dans des gammes de température comprise entre 20 et 55°C.
L'utilisation des protéases s'est faite dans un premier temps pour modifier les propriétés fonctionnelles du gluten et adapter les propriétés rhéologiques des pâtes aux différents procédés de fabrication. Il s'agira dans ce cas de rectifier la force des farines pour diminuer leur viscoélasticité.
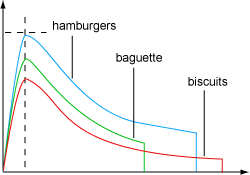
On peut passer ainsi d'une farine forte à une farine panifiable puis à une farine faible force et enfin obtenir une farine pour la confection de biscuit.
Dans ce cas de protéolyse limitée (farine 55, gluten à 27,9%, protéase 0,02%), on n'observe que peu de variation au niveau de l'hydratation (moins de 1%), la résistance à l'étirement peut diminuer de 70%, l'extensibilité gagner 30% et la dépense d'énergie au niveau du pétrissage diminuer de 50%.
Remarque :
Dans un deuxième temps les protéases sont utilisées pour diversifier l'utilisation du gluten par une fragmentation plus importante. Lorsqu'on veut obtenir une solubilisation importante du gluten la protéolyse se déroule pendant 30 minutes à 55°C. La réaction est arrêtée par dénaturation de l'enzyme à 100°C. Si on prolonge le temps de contact avec l'enzyme, il n'y a pas d'augmentation de la solubilisation mais on obtient par contre une fragmentation de plus en plus grande avec des peptides qui possèdent des masses moléculaires de l'ordre de 25kDa et une association de gluténines agrégées.
Voir tableau :
Solubilisation du gluten par une protéase alcaline à différentes températures et différents temps
Lors de la protéolyse on remarque que les protéases à spectre étroit donnent de meilleurs résultats que les enzymes à spectre large. La pepsine va donner des peptides plus importants en taille par rapport à ceux obtenus par la subtilisine, la chymotrypsine ou la papaïne. La trypsine donne des taux d'hydrolyse plus faible que pour la pepsine. Les gros peptides renferment en quantité importante des résidus de proline, glutamine et phénylalanine mais appauvris en résidus basiques. Les séquences N-terminal sont riches en glutamine, valine et isoleucine. Les séquences C-terminal sont riches en leucine, phénylalanine et alanine. On peut aussi obtenir des peptides reliés par des ponts disulfure intercaténaires. Les coupures ont toujours lieu au niveau de la charnière : région répétitive-région non répétitive et plus particulièrement en début de séquence de la région non répétitive. Les parties répétitives sont résistantes à l'action des protéases et les gliadines sont moins hydrolysées que les gluténines.
* Hydrolyse et solubilité : plus l'hydrolyse est poussée plus la solubilité est grande. Cependant cette solubilité va dépendre de la spécificité du système enzymatique qui se répercutera sur la composition des peptides, le taux de fonctions ionisables, la quantité de groupements hydrophobes. Un taux d'hydrolyse de 2% est très largement suffisant pour solubiliser à 90% le gluten à toutes les valeurs de pH. L'augmentation la plus importante est obtenue dans la zone de pH comprise entre 6 et 8 où le gluten natif est quasiment insoluble (pI de la molécule). Les hydrolysats obtenus avec la pepsine sont plus solubles que ceux obtenus avec la trypsine à taux d'hydrolyse équivalent.
* Hydrolysat et capacité d'adsorption d'eau : après hydrolyse la rétention en eau est plus faible car le réseau protéique est détruit. En début d'hydrolyse on peut quelques fois remarquer une augmentation de viscosité due à la reprise en eau des peptides libérés mais ces derniers vont restituer l'eau captée au milieu.
* Hydrolyse et propriétés moussantes : l'hydrolyse du gluten peut se traduire par une augmentation ou une diminution du pouvoir moussant. Le pouvoir moussant est élevé pour des degrés d'hydrolyse compris entre 5 et 12%. Cependant la capacité à stabiliser les mousses diminue quand le taux d'hydrolyse passe de 5 à 10%. Des hydrolysats pepsiques donnent des propriétés moussantes supérieures à celles des hydrolysats de caséine, d'ovalbumine, de gélatine ou de soja.
* Hydrolyse et propriétés émulsifiantes : les hydrolysats de gluten dont le taux d'hydrolyse est compris entre 5 et 12% possèdent de bonnes propriétés émulsifiantes. Ces propriétés sont meilleures à pH acide qu'à pH basique. Au-delà de 12% d'hydrolyse il n'y a plus d'activité émulsifiante. La présence de peptides entraîne une diminution de la vitesse de déstabilisation mais augmente la quantité d'eau dans la phase crémée à l'équilibre.
Voir tableau :
3- Maladie coeliaque
Fondamental :
La maladie coeliaque a été mise en évidence par Dicke en Hollande lors d'une rupture d'approvisionnement en blé au cours de la deuxième guerre mondiale. Une « épidémie » de maladie coeliaque s'est produite en Suède en 1985-1987 suivie d'un déclin en 1995-1997. Il semblerait que la diminution soit due à un prolongement de l'allaitement maternel des nourrissons et une introduction plus tardive de gluten dans l'alimentation infantile. Cette maladie atteint 1 personne sur 1000 à 1500 en France et 1 personne sur 200 ou 400 aux USA. Cette maladie est une entéropathie auto-immune engendrée par un antigène alimentaire. Elle apparaît plus fréquemment chez des individus caucasiens de sexe féminin et se traduit par des diarrhées, un syndrome de malabsorption et une perte de poids. L'atteinte intestinale siège au niveau de l'intestin grêle proximal et associe de façon caractéristique une atrophie villositaire subtotale ou totale, une hypertrophie des cryptes, une infiltration lymphocytaire massive de l'épithélium et un infiltrat lymphoplasmocytaire du chorion. Cette maladie met en jeu une réponse humorale par la biosynthèse de globulines de type IgG et IgA dirigées contre les gliadines du blé et d'un auto-anticorps dirigé vers une enzyme tissulaire : la transglutaminase et une réponse cellulaire en mobilisant le système HLA avec le complexe majeur d'histocompatibilité. La transglutaminase tissulaire est capable de désamider les peptides obtenus par hydrolyse des gliadines et plus particulièrement des gliadines alpha et béta. Ces peptides présentant de nouvelles charges négatives vont interagir préférentiellement au niveau de la poche à peptide des molécules DQ2 et DQ8 qui renferme des acides aminés chargés positivement. Deux séquences peptidiques provenant des gliadines semblent plus particulièrement impliquées il s'agit des séquences suivantes :
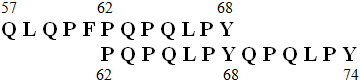
qui sous l'action de la transglutaminase tissulaire deviendront :
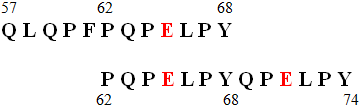
Ces peptides associés aux cellules présentant les antigènes vont réagir avec les lymphocytes T CD4+.
Les anticorps dirigés contre les gliadines sont produits grâce aux signaux auxiliaires fournis par les lymphocytes T CD4+. Les anticorps dirigés contre la transglutaminase n'apparaissent qu'en présence de gliadine ce qui laisse supposer que la transglutaminase pourrait de par sa fonction de couplage entre protéine s'associer avec les gliadines. Ces dernières ne joueraient alors qu'un rôle de transporteur. Il n'existe aucun traitement thérapeutique qui permette de traiter la maladie coeliaque, la seule façon de ne pas la développer quand on est prédisposé est de proscrire toute trace de gluten dans l'alimentation.






