Hydrolyse enzymatique
Si on prend comme exemple la digestion des lipides chez l'Homme, la lipolyse enzymatique sera réalisée par le biais d'estérases. Ces estérases font partie de la classe des hydrolases.
Il faut remarquer que cette réaction met en jeu et, plus particulièrement pour les triacylglycérols un substrat insoluble ou peu soluble dans un milieu aqueux avec une enzyme soluble. Il est donc nécessaire que la réaction s'effectue en présence d'agents émulsifiants qui permettront la fabrication de micelles. La réactivité des lipases va dépendre de la nature du substrat (mono, di ou triacylglycérol), de la nature des acides gras (chaîne courte, moyenne ou longue, présence ou non d'insaturation), de la stéréochimie du substrat (sn1, sn2 ou sn3).
Lipase linguale
Remarque :
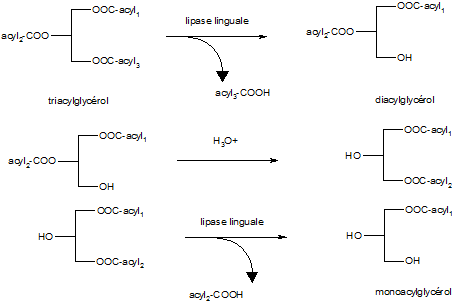
On observe que l'hydrolyse commence par l'action de la lipase linguale (EC 3.1.1.3). C'est une enzyme qui est produite à la partie latéro-postérieure de la langue. Elle possède un pH optimum d'activité compris entre 4 et 6. Elle n'est active qu'au niveau stomacal où elle n'est pas détruite d'une part par la pepsine et d'autre part la constitution du chyme permet par le mélange des aliments (effet mécanique) d'avoir un pH local qui est de l'ordre de 3,5 à 5,5. C'est une enzyme qui réagit plus particulièrement sur les acides gras placés en position sn3 (vitesse de réaction 4 fois plus rapide que sur les acides gras en position sn1 et sn2). Elle hydrolyse 5 à 7 fois plus rapidement les acides gras à courte et moyenne chaîne que les acides gras à longue chaîne.
L'acidité stomacale provoque une isomérisation des acylglycérols et augmente de ce fait le taux d'hydrolyse potentiel de la lipase linguale. A la sortie de l'estomac il est possible de caractériser des mono et des diacylglycérols ainsi que des acides gras libres et du glycérol.
Lipases pancréatiques
Définition :
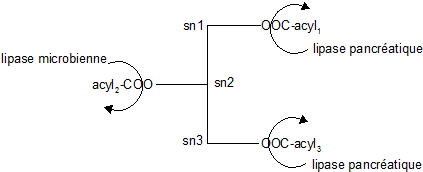
Le chyme acide au contact du duodénum provoque la sécrétion bilio-pancréatique : sels biliaires, lipases et colipase. Les lipides sont émulsionnés par les sels biliaires et, sur cette interface vient se fixer la colipase. La colipase est une petite protéine (10kDa) qui est sécrétées sous la forme d'une procolipase qui sera activée par la trypsine pancréatique après élision d'un pentapeptide. La colipase possède 3 domaines l'un va servir d'ancrage à la lipase pancréatique, un autre domaine est spécifique de la reconnaissance interfaciale et le dernier est un site de reconnaissance micellaire. La lipase pancréatique (EC 3.1.1.3) est résistante à la protéolyse et se fixe par son domaine C terminal à la colipase et par son domaine N terminal au niveau de l'interface. Les acides gras produits sont captés par la colipase et maintenus dans des particules qui se transforment en micelles d'acides gras. En l'absence de colipase, la lipase pancréatique serait inhibée par les acides gras libérés et par les sels biliaires de l'émulsion. Au point de vue de la spécificité de coupure, la lipase pancréatique attaquera préférentiellement les acides gras placés en sn1 puis en sn3 et sera sans action sur les esters en sn2. Les lipases de micro-organismes hydrolysent préférentiellement les groupements acylés en position sn2.
La cholestérol estérase hydrolyse les stérides pour donner du cholestérol et un acide gras.
Les phospholipases vont intervenir sur les lipides complexes du type glycérophosphoaminolipides (lécithines, lysolécithine, plasmalogènes et les phosphatidyléthanolamines). On caractérisera la phospholipase A(1) (EC 3.1.1.32) qui génère des lysolécithines par hydrolyse spécifique du groupement acylé en position sn1, la phospholipase A(2) (EC 3.1.1.4) qui hydrolyse le groupement acylé en position sn2 en libérant du 1-acylglycérophosphocholine. La phospolipase C (EC 3.1.4.3) libère un diacylglycérol et une phosphocholine à partir d'une lécithine.
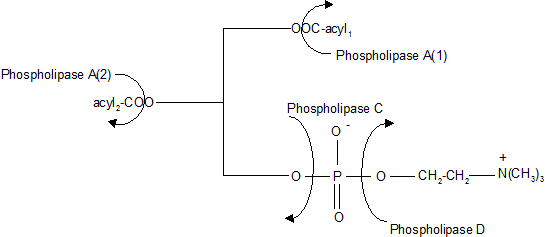
La phosphodiestérase (EC 3.1.4.2) réagira sur une phosphatidylcholine pour donner soit du glycérol phosphate et de la choline soit de la choline phosphorylée et du glycérol.
La phosphomonoestérase (EC 3.1.3.1) hydrolyse le glycérol phosphate en glycérol et acide phosphorique.
Lipases d'origines diverses
Définition :
La phospholipase D (EC 3.1.4.4) d'origine végétale hydrolyse la phosphatidylcholine en donnant de la choline et de l'acide phosphatidique.
Lipolyse et produits agroalimentaires
Remarque :
La matière grasse des fromages est constituée à 98% de triacylglycérols. L'hydrolyse de ces lipides constitue la réaction la plus importante durant la maturation des fromages. Il faut noter que l'utilisation de la présure seule ne permet pas d'obtenir un développement de flaveurs.
Les lipases qu'elles soient isolées de Mucor miehei ou de certaines souches de Penicillium roqueforti sont utilisées pour la fabrication de certains fromages et en particulier des fromages bleus ou italiens (Romano, Provolone). Le goût piquant caractéristique est dû à la présence d'acides gras à courte chaîne (C4:0 à C12:0) libérés par ces lipases soit présentes dans les préparations en pâte de la présure utilisée pour la fabrication de ce type de produit soit encore par ensemencement naturel de micro-organismes présents dans les caves d'affinage.
Les acides gras seront les précurseurs de molécules aromatiques soit à partir de l'hélice de Lynen soit en servant de substrats aux lipoxygénases et autres oxydo-réductases des micro-organismes pour la synthèse de cétones, d'aldéhydes substitués et d'alcools, supports du goût de certains fromages (méthylpropylcétone, pentanol 2, phényléthanol, méthanethiol...).
Dans le genre Penicillium on va mettre en évidence que les propriétés des enzymes sont différentes selon qu'on s'adresse à Penicillium roqueforti ou à Penicillium camemberti.
Dans le cas de Penicillium roqueforti on caractérise 2 lipases différentes de par leur pH d'activité et leur spécificité vis-à-vis des acides gras. La lipase basique (pH optimum 9,0 – 9,5) possède une température optimale d'activité à 30-35°C, elle est activée par les ions magnésium et manganèse. Elle réagira de façon préférentielle sur le tributyryglycérol, elle sera 2 fois moins active sur la matière grasse liquide anhydre (MGLA) et 5 fois moins active sur le trioleylglycérol. La lipase acide (pH optimum 6,0) possède une température optimale comprise entre 35 et 40°C, elle est spécifique des tricaproylglycérols et 5 fois moins active sur le tributyrylglycérol et pratiquement sans action sur la MGLA. Les acides gras libres sont surtout localisés au niveau du mycelium.
Dans le cas de Penicillium camember ti il n'y a qu'une seule lipase analogue à la lipase basique de P. roqueforti mais activée par les ions calcium et présentant une spécificité stricte vers les acides gras polyinsaturés. Les acides gras libres sont localisés sous la croûte.
Les membranes des globules lipidiques diminuent l'action des lipases et il est donc nécessaire si on veut une lipolyse importante de travailler avec du lait homogénéisé. Dans le cas des fromages de type camembert et roquefort, la lipolyse est comprise entre 5 et 10%, elle peut atteindre 20% dans d'autres spécialités de type bleu. Les bactéries lactiques peuvent, elles aussi, apporter leurs lipases qui sont nettement moins actives que les précédentes. Le taux de lipolyse peut atteindre entre 0,5 et 2% comme dans le comté et le gruyère.
L'utilisation des lipases exogènes diminuera considérablement le temps d'affinage des fromages.
Dans le cas de la maturation des jambons secs, on constate que la lipolyse se poursuit au cours des 10 premiers mois de séchage, l'augmentation des acides gras libres est de l'ordre de 10 à 12%. Ce taux est stable par la suite. On observe une augmentation du taux des diacylglycérols et les enzymes semblent réagir préférentiellement sur les triacylglycérols renfermant de l'acide linoléique ce qui explique la présence d'acides gras polyinsaturés. L'hydrolyse des phospholipides est très rapide, leur teneur est inférieure à 0,2% après quelques mois de séchage.






