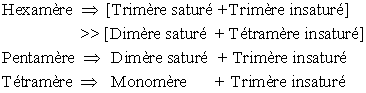Les dépolymérases
On distinguera plusieurs types de systèmes enzymatiques dont les propriétés dépendront du substrat (HM, LM), du mode d'action soit récurrent à partir de l'extrémité réductrice ou non réductrice (exo-enzyme) soit aléatoire à l'intérieur des chaînes (endo-enzyme), de la nature de la réaction mise en jeu (la réaction peut être soit une hydrolyse simple soit une β élimination). On retrouvera à ce niveau les observations déjà faites concernant les enzymes amylolytiques ou cellulolytiques. L'action des enzymes est caractérisée soit par un faible taux d'hydrolyse associé à une forte diminution de la viscosité (endo-enzyme) soit par une faible diminution de la viscosité associée à un fort taux d'hydrolyse (exo-enzyme). Les enzymes auront la possibilité de s'associer avec un substrat et de le dégrader complètement sans détachement du complexe enzyme-substrat ou au contraire d'effectuer une coupure puis se dissocier et recommencer avec une autre chaîne. Il devrait exister de cette façon des exo- et des endopolygalacturonases, des exo- et des endopolyméthylgalacturonases, des exo- et des endopectate-lyases et des exo- et endopectine-lyases. Il n'a pas été possible de caractériser des activités de type : exopectine-lyases ainsi que des exo-polyméthyl-galacturonases. La découverte des lyases a même fait douter de l'existence des polyméthylgalacturonases.
Les exopolygalacturonases
Ces enzymes sont généralement activées par la présence de cations divalents à faible concentration. Elles n'hydrolysent que très faiblement les pectines et sont susceptibles à la conformation du substrat.
Remarque :
(arrêt de l'activité au voisinage d'un rhamnose ou encore en présence d'une irrégularité structurale). Elles attaquent les chaînes comme le fait la β amylase en libérant ici de l'acide galacturonique.
Des enzymes isolées de micro-organismes du genre Pseudomonas sp., et Erwinia sp. sont susceptibles de libérer dans le milieu de l'acide digalacturonique.
Les endopolygalacturonases
Ces enzymes ont une activité qui diminue très rapidement en fonction du degré de méthylation. Au-delà de 70% de méthylation l'enzyme est inactive, lorsque que le taux de méthylation est nul on peut espérer entre 50 et 60% de coupure de liaison. La chute de viscosité est très importante (50%) pour un petit nombre de coupures (0,5 à 10%). Les produits d'hydrolyse sont généralement l'acide digalacturonique et son monomère.
Les lyases
Fondamental :
Ces enzymes sont exclusivement d'origine microbienne.
La réaction est une β-élimination qui se traduit par la coupure d'une liaison glycosidique sans la participation d'une molécule d'eau. Il y a apparition d'une structure cyclique insaturée dérivée de l'acide galacturonique.
Définition :
Les exo-pectate-lyases vont agir à partir de l'extrémité réductrice de la chaîne en libérant un dimère insaturé.
Si l'action s'effectuait sur un tétramère il y aurait production d'un dimère saturé et d'un dimère insaturé. Dans le cas d'un trimère il y aurait production d'un dimère insaturé et d'acide galacturonique. Il faut environ 15% de coupures pour obtenir une perte de viscosité de l'ordre de 50%, l'activité de l'enzyme est indépendante de la taille du polymère.
Définition :
Les endo-pectate-lyases vont réagir à l'intérieur des chaînes avec une affinité généralement plus grande pour les structures faiblement méthylées sauf exception (Arthrobacter sp., Bacillus sp.).
Un très faible taux d'hydrolyse (0,5 à 3%) entraîne une forte chute de viscosité (50%). L'affinité diminue avec la longueur de la chaîne mais les vitesses restent constantes (il y a uniquement modification du Km, qui augmente). Les produits primaires de l'hydrolyse vont pouvoir être repris et hydrolysés à nouveau et ceci jusqu'au trimère qui pourra être dégradé.
Définition :
Les endo-pectine-lyases ne réagissent que sur des pectines hautement méthylées.
L'affinité diminue avec la diminution du taux de méthylation et la vitesse de réaction diminue avec le degré de polymérisation. Un faible taux de coupures (< à 5%) entraîne une perte importante de viscosité (50 %). Les endo-pectine-lyases sont incapables d'hydrolyser les liaisons glycosidiques entre la première et la deuxième liaison à partir de l'extrémité réductrice.