Les prolamines
Définition :
Les prolamines sont solubles dans les solutions étendues d'éthanol (65-75%). Ces protéines ne possèdent pas de propriétés biologiques connues, elles servent de réserve d'azote, de carbone et de soufre pour la plantule au moment de la germination. Ce sont des molécules monomériques qui présentent un polymorphisme génétique important et, il y aura autant de gliadines que de variétés de céréales.
Voir tableau :
Remarque :
Ces protéines sont caractérisées par une forte teneur en acide glutamique (37 à 56%) et en proline (15 à 30%) mais une faible teneur en acides aminés basiques (0,1 à 0,7%). La présence de la proline engendrera des modifications de conformation et des rejets des hélices
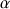 et des feuillets
et des feuillets
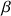 et la présence de nombreux acides aminés apolaires entraînera des difficultés de mise en conformation. Trois groupes de prolamines ont été caractérisés. Les prolamines riches en soufre de hauts poids moléculaires (entre 30 kDa et 55 kDa) et de faibles poids moléculaire ainsi que des gliadines pauvres en soufre (pas de cystéine) de haut poids moléculaire (entre 40 kDa et 80 kDa).
et la présence de nombreux acides aminés apolaires entraînera des difficultés de mise en conformation. Trois groupes de prolamines ont été caractérisés. Les prolamines riches en soufre de hauts poids moléculaires (entre 30 kDa et 55 kDa) et de faibles poids moléculaire ainsi que des gliadines pauvres en soufre (pas de cystéine) de haut poids moléculaire (entre 40 kDa et 80 kDa).
Voir tableau :
Les prolamines renferment 90% des acides aspartique et glutamique sous forme amidée. Si on compare, à masse moléculaire équivalente, il y aurait pour la sérumalbumine bovine 93 fonctions NH3 + et 92 fonctions COO- alors que pour les prolamines on compterait 6 à 11 fonctions NH3 + et 8 à 9 fonctions COO-.
Les prolamines sont toutes construites selon le même schéma : une séquence N-terminale variable de 5 à 15 résidus d'acides aminés, des parties répétitives constituées de dodécapeptides (R) et non répétitives (NR) séparées ou non par des zones de polyglutamines (Q) et une partie C-terminal.
Les séquences répétitives variables peuvent renfermer jusqu'à 100 résidus d'acides aminés et sont constituées par de nombreux résidus de glutamine, de proline et d'acides aminés hydrophobes.
Le domaine C-terminal (homologue pour les différentes gliadines) est constitué de séquences non répétitives renfermant la quasi-totalité des acides aminés soufrés (6 à 8 résidus de cystéine) et permettent la création de 3 à 4 ponts disulfure intracaténaires. Au point de vue de la structure secondaire, le domaine N-terminal présente une majorité de coudes béta et le domaine C-terminal présente plutôt des conformations en hélice alpha et feuillet béta.
Les gliadines
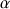 et
et
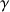 peuvent s'associer par des liaisons non covalentes. Elles ont un comportement agrégatif fort prononcé et forment des associations avec les gliadines de haut poids moléculaire par l'intermédiaire de ponts disulfure intercaténaires. Il existe aussi une classe de gliadine constituée par l'assemblage des différentes gliadines par des ponts disulfure dont la masse moléculaire peut varier entre 100 kDa et 500 kDa.
peuvent s'associer par des liaisons non covalentes. Elles ont un comportement agrégatif fort prononcé et forment des associations avec les gliadines de haut poids moléculaire par l'intermédiaire de ponts disulfure intercaténaires. Il existe aussi une classe de gliadine constituée par l'assemblage des différentes gliadines par des ponts disulfure dont la masse moléculaire peut varier entre 100 kDa et 500 kDa.
Les deux premiers éléments de la figure ci-dessous représentent respectivement de manière schématique la structure des gliadines
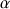 et
et
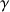 .
.
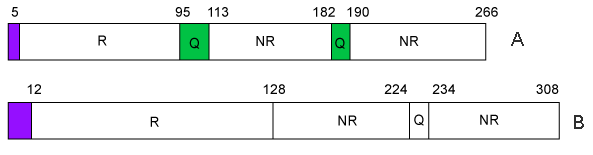
N : domaine à séquence répétitive, NR : domaine à séquence non répétitive, Q : domaine à polyglutamine. A- gliadine alpha, B- gliadine gamma
Remarque :
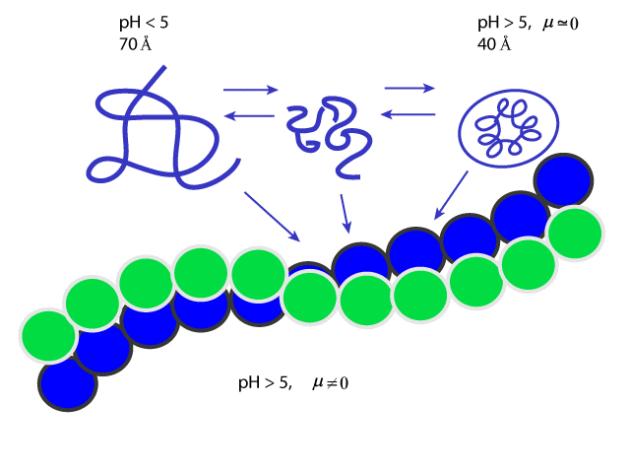
La conformation des gliadines monomériques peut varier en fonction des conditions du milieu. Elles peuvent passer de l'état de pelote statistique pour des pH inférieurs à 5 (diamètre de la molécule 70 Å) à celui de protéine globulaire compacte (diamètre de 40 Å) lorsque le pH du milieu est supérieur à 5 et que la force ionique est très faible (voisine de zéro). Ces structures globulaires s'agrégent pour donner des structures fibrillaires (diamètre de l'hélice 60 Å) quand le pH est supérieur à 5 et la force ionique différente de zéro. Ces modifications de conformation s'accompagnent de modification de l'hydrophobie de surface.
Les gliadines pauvres en soufre (gliadine ω) sont riche par contre en glutamine, proline et phénylalanine mais l'hydrophobie de surface est inférieure aux gliadines γ, α, et β. Le domaine répétitif pourrait dans de nombreux cas recouvrir la totalité de la séquence.
Fondamental :
Les prolamines sont responsables des propriétés d'extensibilité des pâtes.






