Définition du taux d'hydrolyse
Une protéine sous l'action des protéases va se comporter selon le schéma suivant :
Protéine -> Polypeptide -> Peptide -> Acides aminés
Pour chaque molécule, il est possible de définir un nombre total de liaisons peptidiques (h total) qui est équivalent au nombre total des acides aminés moins une unité. Cette information est obtenue après détermination de la séquence primaire des protéines (hydrolyse acide totale et détermination des acides aminés après séparation par chromatographie soit d'échange d'ions soit en phase inverse).On pourra définir le nombre de liaisons peptidiques hydrolysées (h) soit en suivant le taux d'azote soluble en fonction du temps soit en dosant l'apparition des groupements alpha-aminé soit encore par simple dosage volumétrique.
Le taux d'hydrolyse (ΔH%) s'exprimera globalement selon l'expression suivante :
ΔH% = h/h total x 100.
Dans le cas du dosage volumétrique il faudra prendre quelques précautions pour effectuer le dosage. Il faudra se placer à un pH différent du pI des protéines ou des peptides à analyser et surtout il faudra tenir compte des pK d'ionisation des fonctions amine et acide carboxylique. A pH 7,7 – 7,8 les fonctions amines ne sont ionisées qu'à hauteur de 50% alors que les fonctions acide carboxylique sont totalement ionisées. On peut donc admettre à ce moment là et sous les conditions de pH indiquées qu'une fonction acide carboxylique s'ionisera et générera une mole de molécule d'ion H3O+. Chaque liaison peptidique hydrolysée va produire une mole de molécule d'ion H3O+ qui servira au dosage par l'intermédiaire d'une base correctement diluée. L'équation qui permet de connaître le taux d'hydrolyse s'établit de la façon suivante : ΔH% = 1/ (
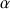 (htotal) x (B x MB)/ MP x 100
(htotal) x (B x MB)/ MP x 100
Où :
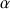 représente le coefficient de dissociation de la fonction acide organique (acide faible :
représente le coefficient de dissociation de la fonction acide organique (acide faible :
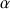 = 10 pH-pK / 1+ 10 pH-pK ), h total : le nombre de liaisons peptidiques, B : le volume (L) de base ajouté, MB : la molarité de la base, MP : la masse (kg) de protéine mise en œuvre.
= 10 pH-pK / 1+ 10 pH-pK ), h total : le nombre de liaisons peptidiques, B : le volume (L) de base ajouté, MB : la molarité de la base, MP : la masse (kg) de protéine mise en œuvre.
La libération de peptides plus solubles permet d'envisager un dosage colorimétrique par le trinitrobenzene sulfonate de sodium qui réagit avec les fonctions amine libre. On pourra même dans ce cas évaluer la taille moyenne des peptides obtenus. Si on considère que la protéine native peut être représentée par PCL0, le nombre de liaisons peptidiques h total sera donné par PCL0 – 1. On peut mettre en évidence une relation entre le ΔH% et la longueur moyenne des peptides représentée par PCL.
Si l'hydrolyse a donné n peptides qui proviennent de la coupure de n-1 liaisons on peut en tirer la relation suivante :
ΔH% = h (n-1) / H total (PCL0 – 1) x 100 (1)
Comme PCL0 est équivalent à n PCL, n s'exprime comme PCL0/PCL et l'expression du ΔH% devient :
ΔH% = (PCL0/PCL) -1 / (PCL0 – 1) x 100 (2)
En simplifiant par PCL0 l'équation précédente devient :
ΔH% = [(1/PCL) -1 / (PCL0 )] / [1- 1 / (PCL0 )] x 100 (3)
Pour les protéines alimentaires où PCL0 est de l'ordre de 200 à 300 (masse moléculaire variant entre 25 et 40 kDa), on peut admettre que le dénominateur de l'équation (3) est voisin de l'unité car 1 / (PCL0 ) est négligeable . Cette extrapolation permet de réécrire l'équation (3)
ΔH% = 1/PCL x 100
Si on prend comme exemple les valeurs suivantes PCL0 voisin de 200 et le ΔH% équivalent à 8% la valeur approchée de PCL est de l'ordre de 12,5. Les valeurs mesurées expérimentalement sont de l'ordre de 11,8 ce qui donne une approximation correcte de la taille des peptides. La présence de pont disulfure va augmenter les valeurs de PCL.
Remarque :
Il est aussi possible de suivre l'hydrolyse par le biais du dosage de l'azote ammoniacal grâce à la méthode de Kjeldahl et l'utilisation des coefficients de conversion azote-protéine. A cet égard il faut noter que certain facteur ne sont pas adaptés bien qu'on continue à les utiliser.
Voir tableau :
Facteurs de conversion appliqués aux protéines
Dans le cas des protéines de soja, on utilise le facteur de 6,25 en sachant qu'il est trop élevé. Il faudrait en fait utiliser le facteur de 5,7 pour être le plus près de la réalité.






