Caractérisation structurale des enzymes
Généralités
Les masses moléculaires apparentes des polyphénol oxydases sont comprises entre 12 et 400 kDa. Cette hétérogénéité s'explique notamment par l'existence de formes polymériques de l'enzyme, pouvant aller du monomère, comme c'est le cas pour la PPO des graines de tournesol à la forme tétramérique pour la tyrosinase de champignon. Les masses moléculaires qui prédominent sont de l'ordre de 120 à 130kDa. Les études structurales ont montré qu'il y avait différents types de chaînes peptidiques : des chaînes peptidiques lourdes (H) dont la masse moléculaire est voisine de 43 kDa et des chaînes légères (L) qui sont au voisinage de 13 kDa. L'enzyme serait en fait l'association de 2 chaînes lourdes associées à 2 chaînes légères selon le modèle H2L2. La forme minimale de réactivité serait la forme HL2 associée avec du cuivre. Il y a généralement entre 1 et 2 atomes de cuivre par sous-unité. La PPO des feuilles de thé possède une masse moléculaire de 140 kDa et 7 atomes de cuivre. Ce cuivre n'est pas lié par liaison de covalence, il peut être facilement éliminé par dialyse contre un agent chélateur (EDTA).
Définition :
D'un point de vue réactionnel, le cuivre se fixe sur l'enzyme avant que celle-ci ne s'associe à l'oxygène dans un premier temps puis au polyphénol dans un deuxième temps selon un mécanisme de type bi-bi ordonné.
Remarque :
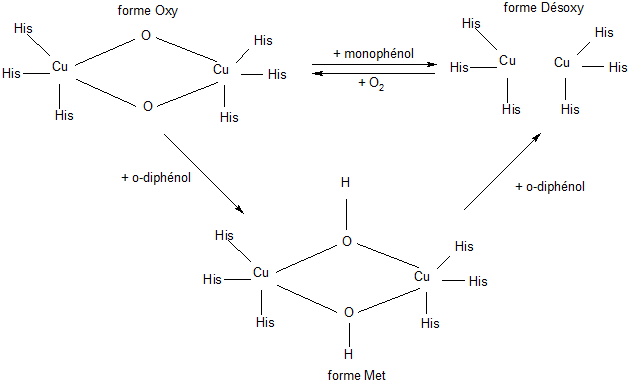
L'enzyme pourra se trouver sous formes réactionnelles : forme Oxy, Désoxy et Met. La forme Met représente l'état majoritaire (ou de repos) dans les extraits enzymatiques. Elle est susceptible d'oxyder les diphénols en quinones. Le site actif passe alors sous forme Désoxy dans laquelle les deux atomes de cuivre sont sous forme réduite. Ils deviennent alors capables de fixer l'oxygène moléculaire pour passer sous la forme Oxy.
Cette dernière forme peut prendre en charge aussi bien les mono que les o-diphénols. Le passage d'une forme à l'autre entraîne des modifications de la géométrie spatiale des six atomes d'azote des résidus histidine et le rapprochement des deux atomes de cuivre l'un par rapport à l'autre (forme Désoxy). Ces phénomènes sont liés à de légères modifications de la conformation tridimensionnelle de l'enzyme au cours de la catalyse.