Mécanisme réactionnel
Définition :
L'activité optimale des PPO se situe généralement dans une gamme de pH comprise entre 4 et 7. On remarque que pour une enzyme d'origine donnée, le pH optimum peut varier en fonction du substrat. Ainsi, le pH optimal de la PPO d'abricot est de 4,4 lorsque le 4-méthylcatéchol est employé et de 6,6 lors de l'oxydation de l'acide chlorogénique dans des conditions similaires. Les enzymes peuvent résister jusqu'à des températures de l'ordre de 70°C. Les enzymes ont été décrites comme pouvant exister sous forme de proenzyme qu'il était possible d'activer soit par le biais des ions H3O+ soit par des acides gras (acide linolénique) soit encore par modification de la conformation. Dans ce dernier cas, il s'agit plus particulièrement des phénol oxydases (tyrosinase) des crustacés qui sont activées par protéolyse. Les crustacés peuvent présenter une mélanose (black spot) qui est due à l'existence au niveau du céphalothorax (dans les hémocytes et la cuticule) d'une prophénol oxydase qui se trouve associée dans un complexe macromoléculaire constitué d'un ensemble de structures différentes les unes des autres. Le complexe prophénol oxydase renferme des structures capables de reconnaître et de s'associer avec : soit des glucanes, soit des peptidoglycanes soit encore des lipopolysaccharides provenant de micro-organismes et d'engendrer une cascade de réactions d'activation en réponse à cette association. Parmi les enzymes activées il y a une sérine protéase qui agira sur la prophénol oxydase et la transformera en phénol oxydase dont l'activité est essentiellement dirigée vers l'oxydation de la tyrosine.
La spécificité dépend de la structure de l'enzyme et des substrats, mais également des conditions expérimentales. La nature et la position des substituants sur les mono ou les o-diphénols sont déterminants pour la réactivité du substrat vis-à-vis de l'enzyme. L'affinité la plus faible est dirigée vers les substitutions en position méta
Fondamental :
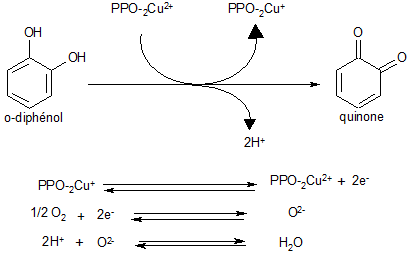
La réaction de brunissement enzymatique est une réaction d'oxydo-réduction où le cuivre va jouer un grand rôle avec le passage des formes cuivriques (Cu2+) aux formes cuivreux (Cu+) et où la régénération de l‘activité de la PPO va se réaliser à partir de l'oxygène moléculaire
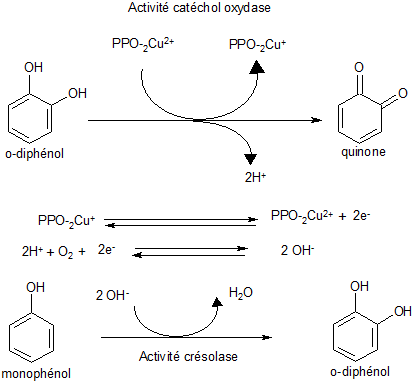
La régénération de la PPO peut aussi se réaliser par l'intermédiaire de la transformation d'un monophénol en diphénol.
Les quinones produites sont des inhibiteurs de la réaction.
Si nous prenons comme exemple la coloration qui accompagne le mûrissement de la banane nous obtenons le schéma réactionnel suivant.
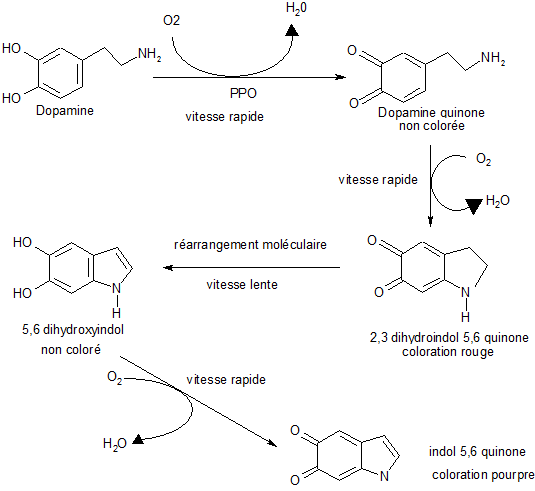
La figure précédente rassemble les réactions qui permettent d'obtenir une coloration par action des PPO sur la dopamine présente dans la banane.
Explication
Il est à noter que seule la première étape est catalysée par les PPO, toutes les autres étapes sont des oxydations chimiques. La vitesse globale de coloration dépend en fait de la vitesse du réarrangement moléculaire qui est le facteur limitant avec une faible vitesse de réaction. Après l'obtention de l'indol 5,6 quinone, l'obtention de mélanoïdines est très rapide.
Ces polymères sont obtenus quand les quinones réagissent avec des molécules du type R-NH2 ou R-SH.






