Action au niveau de l'interaction avec le cuivre
Définition :
Les composés chélateurs de métaux forment des complexes avec les atomes de cuivre du centre actif des polyphénol oxydases. Cette inactivation s'accompagne de l'arrachement d'un des deux atomes de cuivre de l'enzyme conduisant à une forme inactive nommée metapo, l'atome de cuivre encore fixé à l'enzyme restant sous forme oxydée.
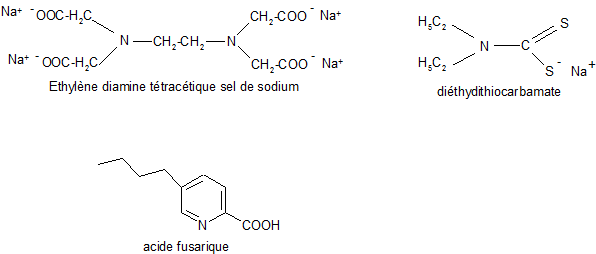
La forme metapo est alors capable de fixer spontanément un atome de cuivre présent dans le milieu, conduisant ainsi à la régénération de la forme native de l'enzyme et à la restitution de l'activité catalytique. L'acide citrique qui est utilisé pour modifier le pH est aussi couramment utilisé pour chélater le cuivre du site actif de l'enzyme. Certains acides, organiques ou non tels que l'acide malique, tartrique, malonique, phosphorique ou chlorhydrique peuvent également être employés. Cependant, leur prix et leur effet sur la qualité organoleptique des aliments représentent leurs principaux inconvénients. D'autres composés sont aussi utilisés comme le 2-mercaptobenzothiazole, l'azide et le cyanure de sodium, le monoxyde de carbone, l'EDTA, l'acide fusarique (toxine de Fusarium lycopersicum), le diéthyldithiocarbamate. Les ions chlorure (les halogènes d'une manière générale) sont également capables de complexer les atomes de cuivre présents dans le site actif de la PPO. Si le chlorure de sodium ou de calcium est fréquemment employé en combinaison avec l'acide ascorbique, son utilisation est limitée par les modifications des propriétés organoleptiques de l'aliment. Parmi les agents chélateurs employés industriellement se trouve le Sporix™ , un polyphosphate acide de synthèse, fréquemment utilisé en mélange avec l'acide ascorbique. L'efficacité de cette préparation dépend fortement du pH de l'aliment traité.
On a pu caractériser des inhibiteurs naturels des PPO chez Dactylium dendroïdes où un peptide de 13 résidus d'acides aminés inhibiteur de la galactose oxydase inhibe aussi les catéchol oxydases des champignons et de pommes en agissant vraisemblablement au niveau du cuivre. On observe le même phénomène chez Agaricus hortensis où un polypeptide de 1000 à 1200 Da renfermant Phé, Asp et Glu en mélange équimoléculaire.






