Dénaturation des protéines
Définition :
La conformation d'une protéine est liée à la structure secondaire et tertiaire, elle est réalisée par l'intermédiaire de liaisons faible énergie donc fragiles. La dénaturation résulte d'une modification des structures quaternaire, tertiaire et secondaire sans fragmentation de la chaîne peptidique. La dénaturation des protéines passe par des structures éphémères qui peuvent aboutir à un déplissement total de la molécule mais on considère aussi que la dénaturation peut résulter d'un accroissement de structure au-delà de la forme native. Le déplissement analogue à une structure en pelote statistique augmente la stabilité des molécules. Cette dénaturation modifie les propriétés des protéines :
baisse de la solubilité par démasquage de groupes hydrophobes
diminution des propriétés d'hydratation
perte d'activité biologique
augmentation de la susceptibilité à la protéolyse
accroissement de la viscosité intrinsèque
inaptitude à la cristallisation
Agents physiques de dénaturation
Action de la chaleur
Dans une réaction chimique lorsque la température augmente de 10°C la vitesse de la réaction est augmentée d'un facteur 2. La dénaturation des protéines s'effectue avec des vitesses qui peuvent être multipliées par un facteur 600. La présence d'eau favorise la dénaturation. Dans un système présentant une phase hydrophile et une phase hydrophobe les protéines dénaturées sous l'action de la température vont venir se placer à l'interface hydrophile/hydrophobe. C'est ce qui est représenté dans le schéma suivant :
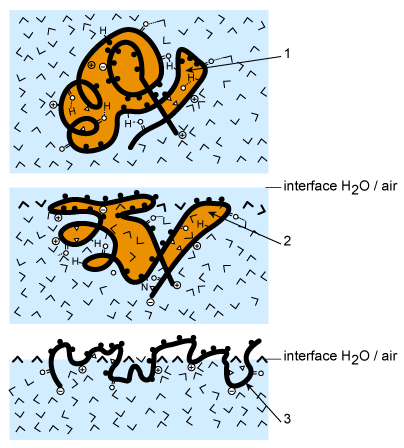
1 : protéine nature ; 2- protéine partiellement déplissée ;
3-protéine dénaturée
Remarque :
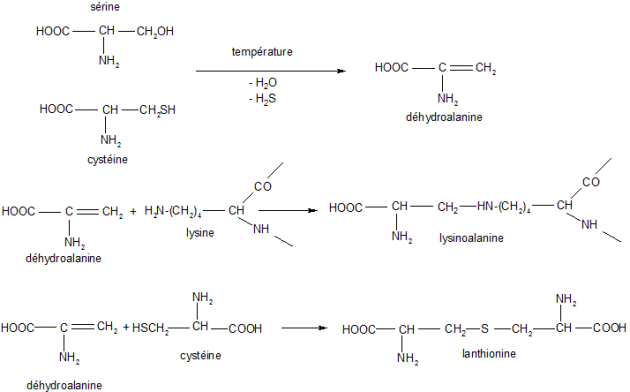
Le traitement thermique peut engendrer de profonde modification comme par exemple la destruction des acides aminés soufrés avec production d'H2S, de diméthylsulfure, d'acide cystéique (cas des protéines laitières, de la viande, de la chair de poisson...), la destruction de la sérine, de la thréonine, de la lysine. Il peut y avoir des réactions de désamination si la température est supérieure à 100°C. L'ammoniac provient des groupements « acétamido » de la glutamine, de l'asparagine, s'il y a modification des propriétés fonctionnelles (modification du pI, apparition de nouvelles liaisons de covalence), il n'y a pas de modification de la valeur nutritionnelle. Si la dénaturation a lieu en présence d'oxygène le tryptophane est perdu d'un point de vue nutritionnel et il peut se retrouver sous la forme de carbolines (
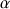 , β, γ) qui peuvent être des agents mutagènes. Si la dénaturation a lieu à haute température, il peut y avoir transformation des acides aminés de la série L à la série D. En milieu alcalin, certains acides aminés sont détruits : L'arginine donne l'ornithine, la citrulline, l'urée, l'ammoniac, la cystéine et la sérine donnent la déhydroalanine qui pourra réagir avec la fonction amine de l'ornithine pour donner l'ornithinoalanine, avec la fonction thiol de la cystéine pour donner la lanthionine. Dans le cas de la lysine on obtiendra la lysinoalanine. Cette molécule est éliminée à part égale par les fèces et les urines. Dans ce dernier cas quand les taux de lysinoalanine sont de l'ordre de 100 ppm on remarque l'installation de nécrose au niveau rénal. Enfin la lysinoalanine diminue le coefficient d'utilité digestive (CUD) des protéines.
, β, γ) qui peuvent être des agents mutagènes. Si la dénaturation a lieu à haute température, il peut y avoir transformation des acides aminés de la série L à la série D. En milieu alcalin, certains acides aminés sont détruits : L'arginine donne l'ornithine, la citrulline, l'urée, l'ammoniac, la cystéine et la sérine donnent la déhydroalanine qui pourra réagir avec la fonction amine de l'ornithine pour donner l'ornithinoalanine, avec la fonction thiol de la cystéine pour donner la lanthionine. Dans le cas de la lysine on obtiendra la lysinoalanine. Cette molécule est éliminée à part égale par les fèces et les urines. Dans ce dernier cas quand les taux de lysinoalanine sont de l'ordre de 100 ppm on remarque l'installation de nécrose au niveau rénal. Enfin la lysinoalanine diminue le coefficient d'utilité digestive (CUD) des protéines.
La figure suivante résume la réaction de déshydratation.
Action du froid
Les basses températures peuvent dénaturer les protéines (enzymes). Des protéines sont susceptibles de s'associer au cours des traitements de congélation comme les gliadines, les protéines aviaires, les protéines du lait... A l'inverse le froid peut entraîner une dissociation des structures oligomériques sans que leur réassociation soit forcément fonctionnelle. Une protéine possédant un rapport acide aminé hydrophobe/acide aminé polaire élevé sera très susceptible à la dénaturation au froid.
Traitement mécanique
Les forces de cisaillement mises en œuvre lors du pétrissage ou du laminage peuvent dégrader les structures secondaires des protéines et entraîner une dénaturation (perte de l'hélicité
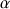 ).
).
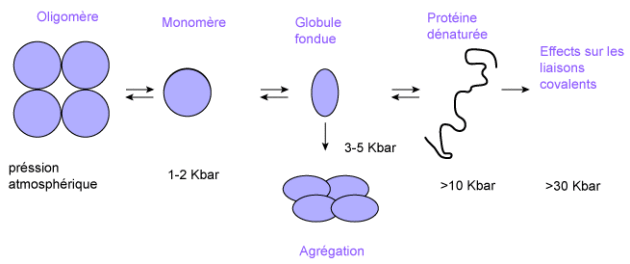
Pression hydrostatique
La dénaturation des protéines intervient dès que la pression est supérieure à 50 kPa : c'est le cas de l'ovalbumine, de la trypsine. Le schéma ci-après décrit le processus général de dénaturation.
Agents chimiques de dénaturation
De nombreux facteurs peuvent intervenir. En premier lieu on peut citer les pH extrêmes qui entraînent un déplissement de la molécule par ionisation de cette dernière et phénomène de répulsion des fragments peptidiques dévoilés. La perte des ions associés à une protéine entraîne la dénaturation des molécules. Les solvants organiques modifient la constante diélectrique du milieu et, par conséquence vont modifier la répartition des charges donc des forces électrostatiques qui maintiennent la cohésion de la structure protéique. Les solvants apolaires peuvent réagir avec les zones hydrophobes et rompre l'interaction hydrophobe qui maintient la conformation de la protéine. A l'inverse on peut assister à une superstructuration des molécules comme par exemple l'augmentation de l'hélicité α dans l'ovalbumine (passage de 31% d'hélice
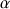 à 85% en présence de chloro-2-éthanol). Enfin les agents chaotropiques et les agents tensioactifs en cassant soit les liaisons hydrogènes soit les interactions hydrophobes entraînent la dénaturation des protéines.
à 85% en présence de chloro-2-éthanol). Enfin les agents chaotropiques et les agents tensioactifs en cassant soit les liaisons hydrogènes soit les interactions hydrophobes entraînent la dénaturation des protéines.