La texturation enzymatique
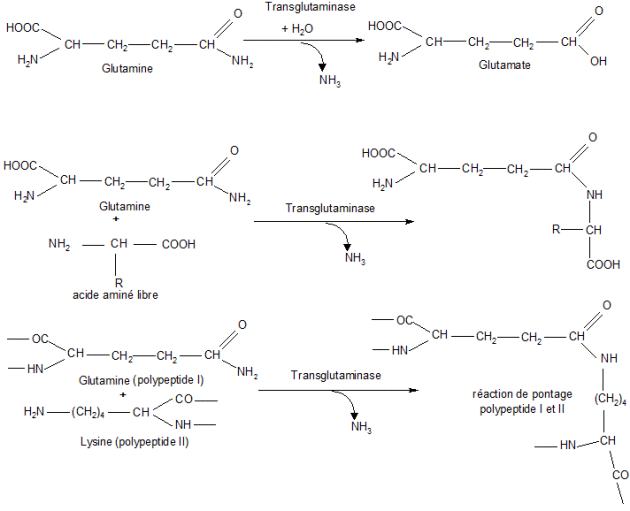
La transglutaminase est une enzyme qui permet d'effectuer les réactions selon la figure suivante :
La fonction carboxamide de la glutamine s'échange avec une fonction amine d'un acide aminé (transfert de radicaux acylés), la fonction ε NH2 d'une lysine ou une amine biogène provenant des réactions de décarboxylation (réaction de réticulation).
Cette réaction n'est possible que dans la mesure ou la fonction
 carboxylique est bloquée sous la forme ester ou amide de façon à éliminer la charge négative exprimée par la fonction acide.
carboxylique est bloquée sous la forme ester ou amide de façon à éliminer la charge négative exprimée par la fonction acide.
La fonction carboxamide de la glutamine réagit avec une molécule d'eau pour donner une réaction de désamination en générant le glutamate.
Remarque :
L'enzyme est isolée de Streptoverticillium mobaraense, elle renferme 331 résidus d'acides aminés pour une masse moléculaire de 40kDa et une fonction thiol libre. C'est une structure monocaténaire non glycosylée bien que renfermant 2 sites potentiels de glycosylation. Le pH optimum d'activité est compris entre 5 et 8. L'enzyme est indépendante de la concentration en calcium (contrairement à la transglutaminase isolée du foie) ceci est un avantage quand on travaille avec des caséines, des globulines du soja ou le complexe d'actomyosine qui précipitent en présence de calcium et, sont de cette façon moins susceptibles à l'action ultérieure de l'enzyme. Elle est stable au pH, sa température optimale d'activité est de 50°C mais elle est capable d'agir à des températures de l'ordre de 10°C. Elle est dénaturée à 70°C.
Cette enzyme est utilisée pour donner des aspects fermes à certains produits ou pour fabriquer une structure tridimensionnelle à partir de solution de protéines dans le secteur des produits carnés, des produits de la mer, des produits laitiers et des produits végétaux.
Méthode :
Dans le cas des produits carnés, on obtient des produits restructurés dans le cas des viandes obtenues par séparation mécanique. Ce procédé permet d'assembler des morceaux en utilisant la transglutaminase associée aux caséinates. Les caséinates en présence de l'enzyme deviennent très visqueux et agissent comme une glue au niveau des différents morceaux. Il y a formation d'un amalgame qui peut être travaillé par la suite.
Dans le cas des produits laitiers, l'utilisation de la transglutaminase est intéressante dans le traitement des caséines qui ne donnent pas de gel par chauffage. Il est possible d'obtenir des substituts de matière grasse par ce traitement, substituts qui peuvent être utilisés dans les sauces de type bolognaise. Cette technique peut aussi être utilisée pour stabiliser des yaourts qui pourraient présenter des problèmes de synérèse importante lors de variation de température ou d'impacts physiques.
Dans le cas des produits d'origine végétale, la transglutaminase est utilisée pour préserver la texture du « tofu » qui est profondément modifiée lors de la stérilisation ou pour augmenter la texture du « yuba », de par son traitement on prévient la destructuration des nouilles et des pâtes après cuisson. On signale que le traitement à la transglutaminase permettrait d'augmenter le volume du pain quand certains ingrédients seraient substitués ou supprimés dans la recette.
Dans le cas des produits de la mer, la transglutaminase permet d'augmenter la texture du surimi (il y a synergie entre enzyme endogène et enzyme microbienne) qui dépend cependant de la fraîcheur du matériel de départ. Le traitement enzymatique permet de réduire les phénomènes de synérèse lors de la décongélation et de la cuisson des produits surgelés.
On peut trouver d'autres applications comme la fabrication de gel de gélatine stable à 100°C et on obtient de cette façon des produits qui ressemblent beaucoup à la texture des ailerons de requin. L'enveloppe des saucisses qui est généralement réalisée par l'interaction du collagène et de réactifs chimiques peut être réalisée par l'utilisation de la transglutaminase en présence de collagène et de gélatine ou à partir d'autres protéines.
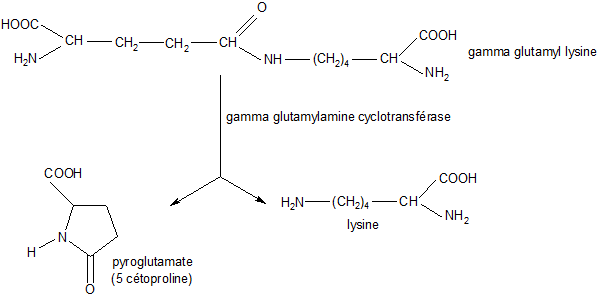
La liaison glutamyl-lysine diminue le coefficient d'utilité digestive (CUD) comme le coefficient d'efficacité protéique (CEP) des protéines. Cette interaction est inévitable pour tous les produits soumis à l'action de la température sauf dans le cas des produits laitiers car il n'y a pas de transglutaminase endogène dans le lait. La lysine est de ce fait indisponible au niveau intestinal, cependant la protéolyse n'est pas complètement bloquée. Elle se réalise et libère généralement un dipeptide qui est glutamyl-lysine. Au niveau rénal il existe une enzyme (la γ glutamylamine cyclotransferase) qui permet la libération de la lysine et la cyclisation du glutamate en pyroglutamate (5-oxoproline) permettant ainsi de récupérer la lysine. Sur cette constatation il est possible d'envisager de complémenter des protéines (protéines de soja, caséine) dont les acides aminés sont limitants. La figure suivante illustre cette action.