Action de la température
A basse température la micelle n'est pas déstructurée mais on assiste à une fuite de caséine β depuis la micelle vers le milieu ambiant. Cette fuite est due au fait que l'abaissement de la température entraîne une diminution des interactions hydrophobes entre les différentes caséines. La fuite est aussi tributaire du pH car à pH 5,2 il y a 3 fois plus de fuite qu'à pH 6,8 pour une température de 4°C. Si l'on veut éviter les freintes protéiques il sera nécessaire de travailler avec des températures très largement positives. A basse température la perte de caséine β et de calcium se traduit par une augmentation de la voluminosité de la micelle par relâchement des structures.
A haute température, il y a cassure des interactions phosphocalciques sans déphosphorylation des résidus de sérine. Il s'en suit plutôt une désorganisation du granule de phosphate. Un chauffage à 120°C pendant 20 minutes entraîne une déphosphorylation à 80% des caséines
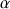 et β.
et β.
Au cours d'un chauffage à 90°C, la β lactoglobuline vient s'associer avec la kappa caséine des micelles soit par des ponts disulfure si le pH est voisin de pH 6,8 soit par des interactions hydrophobes si le pH est inférieur à pH 6,5. Le complexe kappa caséine-β lactoglobuline se sépare de la micelle si le pH est supérieur à pH 6,9 et entraîne une coagulation du lait par déstructuration de la micelle de caséine. Au cours du chauffage, les protéines du lactosérum vont venir s'adsorber sur les micelles en entraînant une diminution du taux des protéines solubles, une augmentation de la taille des micelles et une augmentation de viscosité. Ce comportement est important dans les échangeurs thermiques à plaques puisque cela se traduit par un phénomène d'encrassage de ces derniers (dépôt de micelles à la surface, augmentation de la viscosité, diminution des débits).
En présence de caséines, les concentrés de protéines solubles sont susceptibles de donner des gels blancs, doux avec un aspect analogue à celui du caillé du lait avec une forte synérèse. Les isolats de protéines donnent des gels translucides, fermes (analogues à ceux obtenus avec la gélatine) et présentant une forte rétention d'eau.






