Action du pH
Fondamental :
La réaction de Maillard est favorisée à pH alcalin du fait de la réactivité de l'amine libre sous sa forme basique et de la valeur de son point isoélectrique dans le cas d'un peptide.
La nécessité du pH alcalin s'explique par le fait qu'une fonction amine ionisée ne peut se condenser avec une fonction carbonylée (doublet d'électrons non réactif).
Voir tableau :
Protonation de la fonction amine en fonction du pH du milieu
Explication
Il faut noter que lors de la réaction de condensation entre une fonction carbonylée et une fonction amine d'un acide aminé il peut y avoir une diminution du pH du milieu car la fonction amine disparaît alors que la fonction acide carboxylique peut toujours s'exprimer. Cependant la réaction de Maillard peut s'établir plus facilement en milieu acide quand on est en présence de peptides, de protéines et d'acides aminés aromatiques par rapport aux acides aminés aliphatiques. L'acide p-aminobenzoïque peut donner avec des aldoses des réactions de Maillard dès pH 5,3. En milieu acide, les premiers composés de la réaction de Maillard peuvent être hydrolysés.
Explication
A la lecture de ce tableau où le glucose avait été chauffé à 90-95°C, pendant des temps variables, en présence de différents acides aminés, on voit bien qu'en milieu non tamponné la réaction n'est pas favorisée puisqu'il y a diminution du pH. Cette acidification peut s'accompagner d'une ionisation possible de la fonction amine libre ce qui diminue d'autant le niveau de la réaction (on remarque cependant que les ions H30+ qui favorisent la déshydratation sont des activateurs de la réaction de brunissement). On observe aussi que la fonction amine lorsqu'elle est bloquée ne peut plus donner de réaction de Maillard (cas de la sarcosine et du N-diméthylglycocolle). Enfin et surtout il faut garder en mémoire le fait qu'il ne faut jamais tenter de généraliser le comportement des deux réactants à partir d'une condition expérimentale (cas de l'aminobutyrate). Dans une telle expérience que celle décrite précédemment il faut encore ajouter un facteur supplémentaire qui risque de fausser les interprétations. Quand on soumet un saccharide en présence d'une fonction amine en pH alcalin et à chaud, il faut prendre en compte la stabilité du saccharide et sa propension à donner une coloration par déshydratation interne et production de dérivés du furfural.
C'est ce qui en ressort de l'étude suivante où le glucose et la lysine sont chauffés soit seul soit en présence l'un de l'autre pendant 30 minutes à 120°C.
Voir tableau :
Coloration due à la réaction de Maillard et à la déshydratation des saccharidces
Explication
On observe que la lysine est stable quelque soit le pH alors que le glucose seul va donner une coloration dès pH 6,0. On voit bien qu'en mélange des deux composés et à partir de pH 8,0 deux types de coloration sont obtenues l'une due uniquement au glucose l'autre résultant de la réaction de maillard, vérifiée par la perte d'azote α aminé. Le brunissement global qui sera mesuré sera l'addition de ces deux réactions.
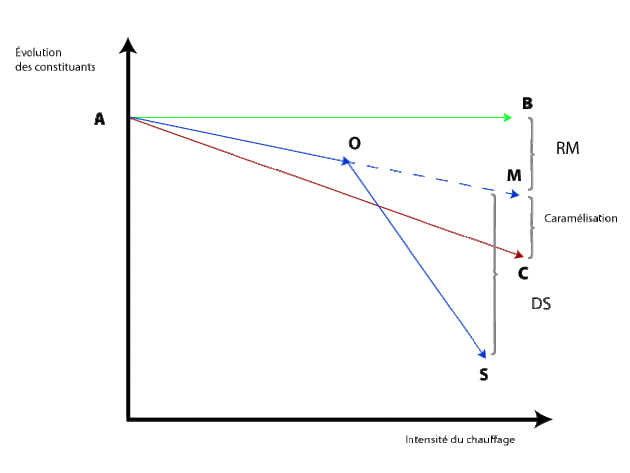
La figure ci-dessous récapitule les réactions où :
AB représente la courbe de stabilité du saccharide et de l'acide aminé,
AB-AM représente la destruction du saccharide et de l'acide aminé par la réaction de Maillard (RM), AM-AC représente la perte de sucre supplémentaire due à la déshydratation interne et la formation de dérivés du furfural (caramélisation),
OM-OS représente la perte supplémentaire de l'acide aminé par la réaction de dégradation de Strecker (DS).
Dans le milieu réactionnel la dégradation du sucre suit la courbe AC, celle de l'acide aminé la courbe AO puis la courbe OS dès qu'il y a des réductones dans le milieu.
En abscisse l'intensité de chauffage et en ordonnée l'évolution des constituants.